








Unedle Metalle reagieren mit verdünnten Säuren, edle Metalle nicht. Die Animation zeigt dazu zwei Beispiele: das unedle Zink reagiert mit Salzsäure unter Bildung von gasförmigem Wasserstoff, das Edelmetall Kupfer zeigt keine Reaktion. Zn + 2 H+
Hierbei läuft eine Redox-Reaktion ab: Zink gibt Elektronen ab, wird also
oxidiert, die aus der Säure stammenden Protonen
werden unter Aufnahme von Elektronen zu Wasserstoff reduziert. |
 Reaktion von Zink und Kupfer mit verdünnter Salzsäure |
||||||||||||||||||||||||||||||||||||||||||||
|
Ursache für das unterschiedliche Verhalten der Metalle ist deren unterschiedliche
Stellung in der Spannungsreihe.
In der Spannungsreihe sind die Metalle nach ihrem Standardpotential Eo geordnet. Das
Standardpotential wird als Spannung zwischen einer Metall-Halbzelle
(z.B. einem Kupferstab, der in eine Kupfersulfat-Lösung der Konzentration
1 mol/l taucht) und der Standardwasserstoffzelle gemessen.
Auch von Redox-Gleichgewichten von Nichtmetallen können Potentiale gemessen werden.
Der Standardwasserstoffzelle (und damit dem Redox-Gleichgewicht
2 H+ + 2 e–
Bei einer Redox-Reaktion wird das unedlere Metall oxidiert, das edlere reduziert. Beispielsweise können Cu2+-Ionen mit Zink oder Eisen reagieren, wobei sich Kupfer abscheidet und Zn2+ bzw. Fe2+-Ionen in Lösung gehen. In der Amalgamfüllung ist Zinn das unedelste Metall. Zinn wird daher als erstes (vor allem durch Luftsauerstoff) oxidiert, wobei Zinnoxid entsteht. Dieses Zinnoxid bildet eine dichte Schutzschicht über dem Amalgam. Da das Volumen des Zinnoxids etwas größer ist, werden auch eventuell vorhandene feine Spalten zwischen Füllung und Zahnschmelz verschlossen. Die Zinnoxidschicht ist beständig gegen verdünnte Säuren, nach etwa 2-3 Wochen erfolgt (normalerweise) keine weitere Oxidation der Füllung und auch die Freisetzung von metallischem Quecksilber nimmt ab. |
|||||||||||||||||||||||||||||||||||||||||||||


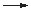 Zn2+ + H2
Zn2+ + H2  H2)
wird das Potential 0 V zugewiesen.
Edlere Metalle besitzen Potentiale > 0 V, unedle Metalle haben
negative Potentiale.
H2)
wird das Potential 0 V zugewiesen.
Edlere Metalle besitzen Potentiale > 0 V, unedle Metalle haben
negative Potentiale.
